
قیمت 19,000 تومان
پروتئین های نوترکیب
پروتئین های نوترکیب
| فصل اول: بررسی منابع پروتئین های نوترکیب |
|
| 1-1- بیوتکنولوژی پروتئینهای دارویی | 1 |
| 2-1- کلونکردن ژن | 3 |
| 1-2-1- ابزار و عوامل کلونکردن ژن | 4 |
| 1-1-2-1- آنزیمهای برشی | 4 |
| 2-1-2-1- آنزيم DNA لیگاز | 5 |
| 2-2-1- وکتورهای کلونینگ | 6 |
| 1-2-2-1- پلاسمیدها | 10 |
| 3-1- سیستمهای بیان کننده مورد استفاده در تولید پروتئین های نوترکیب | 11 |
| 1-3-1- باکتری E. coli بعنوان میزبان بيان کنندة پروتئین های نوترکیب | 15 |
| 2-3-1- وكتور بيانكننده | 15 |
| 1-2-3-1- پروموتر | 16 |
| 1-1-2-3-1- پروموتر T7 و سیستم بیانی PET | 17 |
| 2-2-3-1- منشاء همانندسازی | 18 |
| 3-2-3-1- ماركر انتخابي | 18 |
| 4-2-3-1- خاتمه دهنده رونويسي | 19 |
| 5-2-3-1- سيگنالهاي ترجمه يكي از عوامل مؤثر در افزايش بيان | 19 |
| 6-2-3-1- انتخاب كدون | 20 |
| 4-1- مسائلي در مورد توليد پروتئین های نوترکیب در اشرشياکلي | 21 |
| 1-4-1- پايداري پلاسميد | 21 |
| 2-4-1- عدم حذف متيونين در انتهاي N ترمينال پروتئین های نوترکیب | 22 |
| 3-4-1- بار متابوليکي | 23 |
| 4-4-1- مشکلات بيان پروتئین های نوترکیب در سيتوپلاسم باکتري اشرشياکلی. | 23 |
| 5-1- سيستم ایمنی ذاتی و اكتسابي | 25 |
| 6-1- سایتوکاینها | 25 |
| 1-6-1- فاکتور نکروز کننده تومور (TNF) | 26 |
| 1-1-6-1- ويژگيهاي ژن و مولكول TNFα | 27 |
| 2-1-6-1- ويژگي هاي ساختاري پروتئين TNF | 28 |
| 3-1-6-1- ساختار گیرنده TNF و سوپرفاميلي آنها | 29 |
| 4-1-6-1- نقش بيولوژيكي TNFα | 31 |
| 5-1-6-1- مكانيسم عمل | 31 |
| 7-1- TNF-α و نقش آن در برخي از بيماريهای تحلیل عصبي | 34 |
| 1-7-1- TNF و بیماری آلزایمر(AD) | 34 |
| 2-7-1- TNF و ایسکمی مغزي | 35 |
| 3-7-1- TNF و بیماری پارکینسون | 36 |
منابع پروتئین های نوترکیب
سیستمهای بیان کننده مورد استفاده در تولید پروتئین های نوترکیب
انتخاب نوع سیستم بیان کننده برای تولید انبوه پروتئین های نوترکیب، به عوامل متعددی وابسته است که در این بین میتوان ویژگیهای رشد سلول میزبان، میزان بیان پروتئین های نوترکیب، بیان درون سلولی یا خارج سلولی، تغییرات پس از ترجمه پروتئین فعالیت زیستی و خصوصیات پروتئین مورد نظر و هدف نهایی استفاده از پروتئین بیان شده را نام برد(Makrides, 1996).
امروزه از سيستمهاي بيان كننده متعددي براي توليد پروتئین های نوترکیب استفاده ميكنند كه به دو گروه تقسيم ميشوند.
- سيستمهاي پروكاريوتيك شامل اشرشياكلي، باسيلوسوبتيليس، سودوموناس، اروينيا و…
- سيستــمهاي يوكاريوتيــك مخمرهـــا، حشرات، سلولهاي پستانـداران و سلولهـاي گياهي
Johnson and et al., 1988)).
هر یک از سیستمهای بیان کننده که در بالا ذکر شد دارای مزایا و معایبی هستند که در جدول 2-1 ارائه شده است.
جدول2-1: معایب و مزایای سیستمهای بیان کننده مختلف جهت تولید پروتئین های نوترکیب (Walsh and Headon, 1994)
| معایب | مزایا | میزبان |
| پروتئین نوترکیب فاقد تغییرات پس از ترجمه خواهد بود. | تنوع زیاد | اشرشیاکلی |
| فعالیت زیستی و ایمنیزایی پروتئین نوترکیب ممکن است متفاوت از پروتئین طبیعی باشد. | امکان کنترل بیان ژن | |
| پروتئینهای بیان شده گاهی به صورت اجسام ذخیره(inclusion bodies) در میآیند. | تولید پروتئین نوترکیب بسیار بالا است (تقریباً 50 در صد کل پروتئینهای سلولی) | |
| رشد سریع و کشت آسان | ||
| پروتئین نوترکیب قابل بیان به صورت پروتئینهای الحاقی است. | ||
| پروتئین نوترکیب را میتوان طوری طراحی کرد که به محیط کشت ترشح شود. | ||
| امکان تولید انبوه پروتئین نوترکیب، همانند E. coli وجود ندارد. | پروتئین بیان شده به صورت الحاقی را مستقیماً به محیط کشت ترشح می کند. | استافیلوکوکوس اورئوس |
| یک عامل بیماریزا است. | ||
| ژنتیک آن به خوبی شناخته نشده است. | فاقد آندوتوکسین است. | مخمر سارکارومیس سرویزیه |
| کنترل بیان ژن در آن به سادگی امکانپذیر نیست. | به عنوان میکروارگانیسم بیضرر شناخته شده است. (GRAS15) |
| معایب | مزایا | میزبان |
| دستکاری ژنتیکی پلاسمیدهای مخمری مشکل است. | برای انسان بیماریزا نیست. | |
| وکتورهای کلونینگ کمی در دسترس است. | تولید انبوه پروتئین و فرآیندهای پایین دستی آن به خوبی راهاندازی شده است. | |
| گلیکوزیلاسیون مخمر مشابه گلیکوزیلاسیون پستاندارن نیست. | فرمانتاسیون مخمر بسیار ارزان است. | |
| امکان گلیکوزیلاسیون و تشکیل باندهای دیسولفیدی در آن فراهم است. | ||
| فقط 5/0 در صد پروتئینهای طبیعی ترشح میشوند که این امر تخلیص پروتئین نوترکیب ترشح شده به محیط کشت را آسان میسازد. | ||
| بیان پروتئین نوترکیب به صورت انبوه امکان پذیر نیست. | تجارب فراوانی از فرمانتاسیون قارچهای رشتهای در دسترس است. | قارچ آسپرزیلوسSP |
| ژنتیک آن به خوبی شناخته نشده است. | رشد آن ارزان است. | |
| وکتورهای کلونینگ در دسترس نیست. | منبع بسیاری از آنزیمهای صنعتی است. | |
| آسپرژیلوس نیجر، GRAS است. | ||
| مقادیر فراوانی از پروتئین را میتواند به محیط کشت ترشح کند. | ||
| عدم مشابهت سیستمهای گلیکوزیلاسیون حشرات و پستانداران | واجد بسیاری از مکانیسمهای پردازشی لازم برای پروتئینهای یوکاریوتهای عالیتر است. | کشت سلولهای حشرات
(Baculovirus vector) |
| پروتئین نوترکیب تولید شده همیشه 100 در صد فعال نیست. | وکتور باکولوویروسی برای آزمایشهای کلینیکی پروتئینهای نوترکیب توسط FDA تایید شده است. |
| معایب | مزایا | میزبان |
| تفاوت بسیار کم در عملکرد و خصوصیات آنتیژنیک محصولات نوترکیب وجود دارد. | ||
| به دلیل عفونتهای ویروسی در سلولهای کشت شده، تولید پروتئینهای میزبان تا حدی متوقف میشود ولی ژنهای خارجی در سطوح بسیار بالا بیان میگردد. | ||
| تخلیص مقرون به صرفه و ساده پروتئین نوترکیب امکانپذیر است. | ||
| کشت سلولها مشکل است. | فعالیت زیستی پروتئین در آن مشابه پروتئینهای طبیعی است. | سلولهای پستانداران |
| در صنعت گران است. | وکتورهای بیان کننده پروتئینهای پستانداران به صورت تجاری در دسترس است. | |
| رشد سلولها به کندی انجام میگیرد. | آنها را میتوان در مقیاس انبوه کشت داد. | |
| سلولهای دستکاری شده ژنتیکی معمولاً ناپایدارند. |
باکتری E. coli بعنوان میزبان بيان کنندة پروتئین های نوترکیب
در فرآیند تولید یک پروتئین های نوترکیب گام اول بیان پروتئین هدف در میزبانE. coli است. اشرشیاکلی یک باکتری گرم منفی است و فقط یک کروموزوم دارد که در ساختار به هم فشردهای به نام نوکلوئید[1] بستهبندی شده است. E. coli به دليل دارا بودن ويژگيهايي از قبيل تكثير سريع، مصرف كم مواد اوليه، كنترل آسان رشد، بيان بالاي پروتئین نوترکیب، قدرت بالاي پذيرش ژنهاي بيگانه، شناخت ويژگيهاي ژنتيكي و فيزيولوژي آن را به عنوان ميزباني بسيار كارآمد براي تحقيقات مهندسي ژنتيك و دستكاريهاي ژنتيكي ساخته است. سويهاي از باكتري E. coli بنام Kl2 به طور گستردهای تحت مطالعات بیولوژیکی قرار گرفته و تمام سویههای جدید از این سویه اصلی مشتق شدهاند(محمودپور، م، 1381). بطور معمول براي بيان ژن و توليد انبوه پروتئين از سويههايي مانند DE3 (BL21) استفاده ميشود.
مسائلي در مورد توليد پروتئین های نوترکیب در اشرشياکلي
پايداري پلاسميد
عوامل متعددي از قبيل ميزان رونويسي ژن کلون شده، شرايط رشد، مارکرهاي شناساگر، استعداد ژنتيکي ميزبان و سميت ژنهاي موجود بر روي وکتور به ميزان زيادي پايداري پلاسميد را تحت تاثير قرار مي دهد. ناپايداريهاي پلاسميدي را ميتوان به سه گروه عمده تقسيم نمود.
1- ناپايداري تسهيمي[1] که از سيستم ناقص توزيع DNA پلاسميدي در طي تقسيم سلول ناشي ميشود. همچنين ترکيب محيط کشت، تثبيت سلولي، دما، هوادهي و PH از جمله عوامل موثر بر ناپايداري تسهيمي هستند(Beal and et al., 1998) .متاسفانه يک فرمول خاصي براي افزايش ميزان پايداري پلاسميد به وسيله تنظيم شرايط محيط کشت وجود ندارد و اين شرايط براي حالتهاي مختلف بيان ژن و حتي ممکن است براي بيان ژنهاي مختلف متفاوت باشد. به طور کلی سلولهاي حاوي پلاسميد به انرژي بيشتري نسبت به سلولهاي بدون پلاسميد نياز دارند. بنابراين بايد از کمبود اکسيژن و موادغذايي در طي رشد و فرمانتاسيون[2] جلوگيري شود(Edlin and et al., 1984).
2- ناپايداري ساختاري که از تغييرات در ساختار DNA پلاسميدي، نظير حذف، دخول يا بازآيي ناشي ميشود. پايداري ساختاري پلاسميد به ويژگيهاي ژنتيکي ميزبان، ساختمان پلاسميد و شرايط رشد بستگي دارد.3- ناپايداري رقابتي[3] که از برتري رشد سلولهاي فاقد پلاسميد نسبت به سلولهاي واجد پلاسميد در محيطهاي کشت ناشي ميشود(Strandberg and et al.,1991 and Huang and et al., 1997).
فاکتور نکروز کننده تومور (TNF):
فاکتور نکروز کننده تومور یکی از سایتوکاینهاي دخيل در راهاندازی و تنظیم سيستم ايمني ذاتی است که پاسخهای التهابی حاد در برابر باکتریهای گرم منفی و سایر میکروبها را وساطت میکند
(Abul and Lichtman, 2007). براي اولين بار TNF به عنوان فاكتوري كه در مرگ سلولهاي توموري نقش ايفاء ميكرد از سرم موشهاي تيمار شده با آندوتوكسين باكتريها جداسازي شدSanjay, 2007) ) اگر چه وجه تسمیه این فاکتور به علت ویژگیهای ضد توموری آن است اما TNF در طیف گستردهای از بیماریها دخالت دارد.
فاکتور نکروز کننده تومور راTNFα نيز مينامند تا از TNFβ يا لنفوتوکسین(LT) متمایز شود(Abul and Lichtman, 2007). مقایسه توالی آمینواسیدی TNF و LT نشان دهنده ارتباط نزدیک آنها است از طرفی بررسی نقشه کروموزومی نشان میدهد که ژنهای کد کننده آنها بر روی بازوی کوتاه کروموزوم 6 و در مجاورت ژنهاي MHC (Major Histocompatibility Complex) در کنار هم دیگر قرار میگیرند و این حاکی از آن است که این دو از یک ژن مشترک منشاء گرفتهاند (Old, 1985).
تنوع تيپهاي سلولي كه فاکتور نکروز کننده تومور در آنها بيان ميشود در مقایسه با لنفوتوکسین بیشتر است. TNFα غالباً توسط ماکروفاژهای فعال، لنفوسیت هایT ي CD4+، لنفوسیتهایT يCD8+، سلولهای NK، بيان ميشوند. بیان آن در سلولهای دیگر مانند فیبروبلاستها، سلولهای عضلات صاف و سلولهای توموری پایین است(Vilcek and Lee, 1991). بعلاوه اين ژن در سال 1985 توسط Duinppon كلون شد.
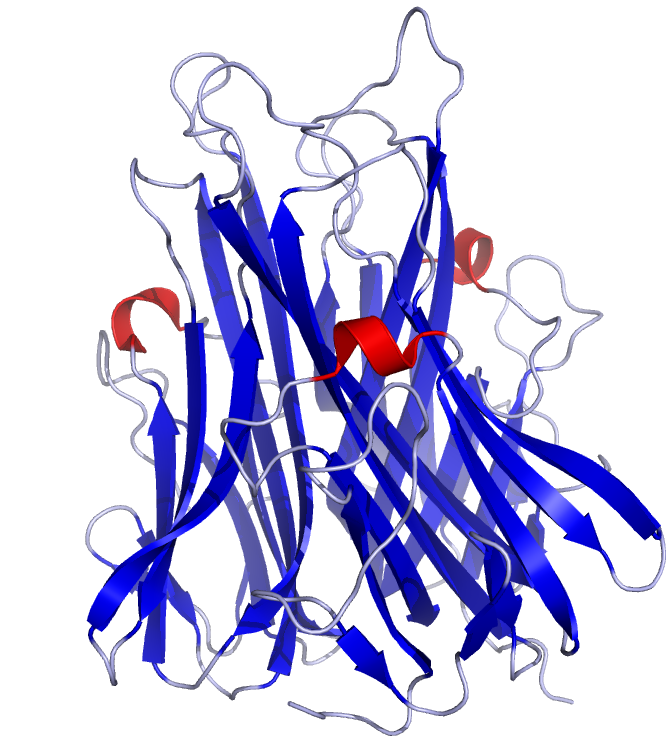
نقش بيولوژيكي TNFα:
فاکتور نکروز كننده تومور آلفا ((TNFα سایتوکایني با عملكردهاي متعددي است و مسيرهاي سيگنالي زيادي را در سلول القاء ميكند. علاوه بر دخالت در آپوپتوزیس، زنده ماندن سلول، التهاب، تنظيم خواب و رشد رويان دارای نقشهاي درماني مهمی مانند مقاومت به عوامل عفوني و نيز مقاومت به تومور مي باشد (Vilcek and Lee, 1991.,Wride and Sanders, 1995., Aggarwal, 2003 and Krueger, 2008).
TNFα قادر به القاء مرگ سلولي آپوپتوزي و نكروزي ميباشد(Beyaert and Fiers, 1994). نكروزه شدن با ويژگيهايي مانند متورم شدن سلول، تخريب اندامكها، ليز شدن سلول و پاسخهاي التهابي همراه است در حالي كه آپوپتوز يك فرآيند بيوشيميايي است كه با ويژگيهاي مورفولوژيكي خاصي مانند چروكيده شدن سلول، تشكيل اجسام آپوپتوزي و تشكيل قطعات DNA نوكلئوزومي مشخص مي گردد(Steller, 1995).
TNFα ممكن است از طريق فعال كردن نوتروفيلها، پلاكتها و افزايش توانايي ماكروفاژها، سلولهاي NK و تحريك سيستم ايمني باعث ايجاد مقاومت در برابر عفونتها ميشود. از طرفي در برخي بيماريهاي خود ايمني مانند آرتريت روماتوئيد نيز نقش ايفاء ميكند(Abul and Lichtman, 2007).
پروتئین های نوترکیب
جهت مشاهده نمونه های دیگر از فصل دوم مهندسی کشاورزی کلیک کنید.
نمونه ای از منابع لاتین پروتئین های نوترکیب
- Abul, A. K. and Lichtman, A. H. (2007). Cellular and Molecular Immunology. W.B Saunders Company.
- Aggarwal, B. B. (2003). Signalling pathways of the TNF superfamily: a double-edged sword. Nature Reviews Immunology., 3: 745-756.
- Ashkenazi, A. and Dixit, V. M. (1999). Apoptosis control by death and decoy receptors. Current Opinion in Cell Biology., 11(2): 255-260.
- Balbas, P. and Bolivar, F. (1990). Design and construction of expression plasmid vectors in Escherichia coli. Methods in Enzymology., 185: 14-37.
- Banerjee, S. and Apte Deshpande, N. (2009). A Novel Cytokine Derived Fusion Tag for Over-Expression of Heterologous Protein in E. coli. International Journal of Biological and Life Sciences.1(3): 129-133.
- Baneyx, F. (1999). Recombination protein expression in Eschershia coli. Current Opin Biothecnology., 10: 411-421.
- Beal, C., D’Angio, C., et al. (1998). pH influences growth and plasmid stability of recombinant Lactococcus lactis subsp. lactis. Biotechnology Letters., 20(7): 679-682.
- Berent, S. L., Torczynski, R. M., et al. (1986). Sendai virus induces high levels of tumor necrosis factor mRNA in human peripheral blood leukocytes. Nucleic Acids Research.14(22): 8997-9015.
- Beutler, B. and Bazzoni, F. (1998). apoptosis ana autoimmunity: a common thread? Blood Cells Mol Dis., 24: 216-230.
- …
- …
نقد و بررسیها
هنوز بررسیای ثبت نشده است.









نقد و بررسیها
هنوز بررسیای ثبت نشده است.