
قیمت 19,000 تومان
پوسیدگی ذغالی کنجد…………………………………………………………………………………………………………………..
2-2- قارچ عامل بیماری M.phaseolina……………………………………………………………………………….
2-2-1- ریخت شناسی قارچ M.phaseolina…………………………………………………………………………
2-2-2- زیست شناسی قارچ M.phaseolina…………………………………………………………………………
2-2-3- چرخه بیماری…………………………………………………………………………………………………………………
2-2-4- مکانیزم آلودگی و بیماریزایی………………………………………………………………………………………….
2-3- دامنه میزبانی قارچ M.phaseolina………………………………………………………………………………..
2-3-1- دامنه میزبانی قارچ در ایران…………………………………………………………………………………………….
2-4- روش های کنترل بیماری…………………………………………………………………………………………………….
2-4-1- کنترل زراعی…………………………………………………………………………………………………………………..
2-4-1-1- تغذیه متعادل و مناسب………………………………………………………………………………………………
2-4-1-2- آبیاری مناسب…………………………………………………………………………………………………………….
2-4-1-3- غرفاب کردن خاک قبل از کشت………………………………………………………………………………..
2-4-1-4- تناوب زراعی با غیر میزبان…………………………………………………………………………………………
2-4-1-5- حذف اندام های آلوده محصول بعداز برداشت…………………………………………………………..
2-4-1-6- استفاده از بذر سالم و عاری از عامل بیماری……………………………………………………………..
2-4-2- کنترل شیمیایی………………………………………………………………………………………………………………..
2-4-3- کنترل بیولوژیک……………………………………………………………………………………………………………..
2-5- مدیریت زراعی……………………………………………………………………………………………………………………
2-5-1- تأثیر عملیات شخم زنی در تراکم جمعیت قارچ M.phaseolina در خاک………………..
2-5-2- بکارگیری ارقام مقاوم……………………………………………………………………………………………………..
2-6- انواع مقاومت………………………………………………………………………………………………………………………
2-6-1- مقاومت حقیقی………………………………………………………………………………………………………………
2-6-2- مقاومت ظاهری………………………………………………………………………………………………………………
2-6-3- مقاومت غیر میزبانی……………………………………………………………………………………………………….
منابع
قارچ عامل بیماری M.phaseolina
پوسیدگی ذغالی کنجد
عامل بیماری قارچی خاکزی و بذرزاد بوده که از طریق کاشت بذور آلوده و جوانه زدن اسکلروت های موجود در داخل خاک و تماس با ریشه های کنجد باعث آلودگی بوته ها می گردند. علائم بیماری ابتدا به صورت لکه های خاکستری تا سیاه رنگ بر روی پایه کوتیلدونها تشکیل شده و به طرف بالا توسعه می یابد و در صورت وجود هوای گرم و خشک باعث از بین رفتن بوته ها می گردد. در هوای خنک و مرطوب عامل بیماری به صورت پنهان در بوته ها باقی مانده و علائم بیماری در اواسط تابستان در شرایط دمایی بالای 30-28 درجه سانتی گراد و رطوبت پایین خاک ظاهر میشود.
بعد از مرحله گل دهی در هوای گرم و خشک علائم بیماری ابتدا به صورت سبز کمرنگ و زرد شدن و در نهایت به صورت خشک شدن برگ ها ظاهر می شود. در این هنگام اسکلروت های سیاه رنگ فراوانی در زیر بافت اپیدرم تشکیل شده که با پاره شدن آن رنگ سیاه و ذغالی آنها به خوبی مشاهده می گردد (Sinclair andbakman,1989). بوته های آلوده به بیماری پوسیدگی ذغالی دارای تعداد غلاف کمتر بوده و دانه های تشکیل شده در درون غلافها چروکیده و دارای وزن کمتری میباشند. تهیه ارقام مقاوم یکی از روش های اصلی مدیریت کنترل بیماری پوسیدگی ذغالی کنجد است (Wylie,1988).
کنجد (Sesamum indicum L.) یکی از قدیمی ترین گیاهان کشت شده توسط بشر در جهان است. دانه های کنجد بسته به شرایط آب و هوایی و نوع رقم دارای 45 تا 62 درصد روغن است. وجود آنتی اکسیدان سزامولین (Sesamolin) در روغن کنجد باعث دوام خوب آن می گردد .(Roebbelen et al., 1989)مقاومت به قارچ M.phaseolina در بعضی از محصولات زراعی توسط دو ژن غالب و مکمل یدیگر (Mp1and Mp2) انجام میگیرد. این دو ژن غالب به صورت (AABB, AaBB, AABb, AaBb) که آلل های یکدیگر هستند. انتقال این ژنهای غالب در نسلهای بعدی با قانون مندل به نسبت 3:1 پیروی می کنند. برای مقاومت به قارچ M.phaseolina حضور هر دو ژن غالب ضروری است ولی ممکن است یک ژن هموزیگوس و ژن دیگر هتروزیگوس باشد(Olaya et al., 1996) .
در یک طرح تحقیقاتی 18 والد ماده کنجد با 10 والد نر کنجد تلاقی داده شدند و 180 نتاج حاصل در برابر بیماری پوسیدگی ذغالی مورد ارزیابی قرار گرفته که اختلاف معنی داری از نظر عکس العمل به بیماری فوق در بین نتاج مشاهده گردید .(Solanki et al., 2006)در آزمایش مزرعه ای 28 ژنوتیپ کنجد برای تعیین میزان تحمل به بیماری فوزاریومی مورد ارزیابی گرفتند. در این آزمایش تعداد 2 ژنوتیپ در برابر بیماری تحمل خوبی نشان داده که برای استفاده در برنامه های اصلاحی جهت تهیه ارقام مقاوم معرفی گردیدند (Bramawy and Abdul – Wahid, 2009) .
در یک ازمایش مزرعه ای نسلهای 3F و 4F حاصل از دیالل گراس یک طرفه در سال 2005 – 2004 در برابر بیماری پوسیدگی ذغالی مورد ارزیابی مزرعه ای قرار گرفتند. در این آزمایش اختلاف معنی داری بین ژنوتیپ ها از نظر تحمل به بیماری وجود داشت که ژنوتیپ های برتر در برنامه های اصلاحی مورد استفاده قرار گرفتند. میزان این آلودگی در نسل 3F بین 91/50٪ – 01/1٪ در بین ژنوتیپ های مختلف مشاهده گردید (Bramawy and Abdul-wahid, 2006). پوسیدگی ذغالی کنجد یکی از مخربترین بیماریهای کنجد در کشور مصر بشمار می آید .(Abdou et al., 2001) بیماری پوسیدگی ذغالی کنجد یکی از گسترده ترین و خطرناکترین بیماری کنجد در هندوستان بوده که کنترل آن مشکل می باشد (Maiti et al., 1985).
تعداد 13 رقم کنجد در کشور ونزوئلا برای مقاومت به بیماری پوسیدگی ذغالی مورد ارزیابی مزرعه ای قرار گرفتند. آزمایش نشان داد که از بین ارقام سه رقم تحمل بیشتری در برابر بیماری در مقایسه با شاهد از خود نشان دادند (Avila Melean and Fernandez-Martinez, 2003). ارزیابی هفت رقم کنجد در استان خوزستان نشان داد که ارقام مختلف دارای درجات متفاوتی از آلودگی به بیماری پوسیدگی ذغالی هستند. در این آزمایش رقم ناز تک شاخه با 100٪ آلودگی حساسترین و داراب 14 با 0٪ آلودگی مقاومترین ارقام نسبت به بیماری بودند (بوشهری، 1383).
با مطالعه میکوفلور بذر کنجد در استان فارس قارچ M.phaseolina نیز مورد شناسایی قرار گرفتند (بصیرنیا و بنی هاشمی، 1383). ارزیابی ارقام و لاینهای پیشرفته کنجد نسبت به بیماری پوسیدگی ذغالی در آزمایشگاه بر روی کاغذ صافی نشان داد که ارقام داراب 14، خانوک زرند کرمان، فائو 2، هندی 1 و Co-1 بالاترین میزان حساسیت و در مقابل ارقامی مثل چینی، ورامین 2822 و پتک موسیان دارای سطوح بالایی از مقاومت بودند (گرمارودی و منصوری، 1383).
بیماری پوسیدگی ذغالی کنجد (M.Phaseolina) یکی از بیماری های مهم کنجد در استانهای شمالی کشور محسوب می شود. این بیماری برای نخستین بار در سال 1345 روی کنف توسط شریف و ارشاد و بر روی سویا در سال 1358 توسط زاد از شمال ایران گزارش شده است. این بیماری بر روی کنجد از استان گلستان توسط گلزار در سال 1368 گزارش گردید (ارشاد 1368).
این بیماری تاکنون بر روی 500 گونه گیاهی از سراسر جهان گزارش گردید (Doupni, 1993). در استان مازندران این بیماری بر روی گیاهان زراعی شامل سویا، آفتابگردان، کنجد، کلزا و توت فرنگی گزارش گردید.
بررسیهای انجام شده در ایران در سال های 81-80 نشان داد که ارقام و لاین های مختلف کنجد واکنشهای متفاوتی نسبت به این بیماری دارند که انجام این بررسی ها منجر به معرفی دو رقم متحمل به نام های ساری و تلار در استان مازندران گردید ( سیاوش رعیت پناه و همکاران 1381 , سیاوش رعیت پناه و همکاران 1383). مقاومت به قارچ M.phaseolina در بعضی از محصولات زراعی توسط دو ژن غالب و مکمل یدیگر (Mp1and Mp2) انجام میگیرد. این دو ژن غالب به صورت (AABB, AaBB, AABb, AaBb) که آلل های یکدیگر هستند. انتقال این ژنهای غالب در نسلهای بعدی با قانون مندل به نسبت 3:1 پیروی می کنند. برای مقاومت به قارچ M.phaseolina حضور هر دو ژن غالب ضروری است ولی ممکن است یک ژن هموزیگوس و ژن دیگر هتروزیگوس باشد (Olaya et al., 1996).
قارچ عامل بیماری M.phaseolina
قارچ M.phaseolina (Tassi) Goidanich بیمارگر تعداد زیادی از گونه های وحشی و زراعی در نواحی گرمسیری جهان می باشد و عامل بیماری پوسیدگی زغالی، بلایت برگی، بلایت ساقه و مرگ گیاهچه است ((Blanco-Lopez and Jimenez-Diaz, 1983. قارچ عامل بیماری اولین بار در سال 1901 توسط تسائی به نام M.phaseolina معروف گردید. سپس دانشمندان دیگر بر اساس خصوصیات مرفولوژیکی نام های متفاوتی را برای آن در نظر گرفتند. معتبرترین نام علمی انتخاب شده برای این قارچ M.phaseolina می باشد که توسط گویدانیج در سال 1974 انتخاب شد (Singleton et al., 1992).
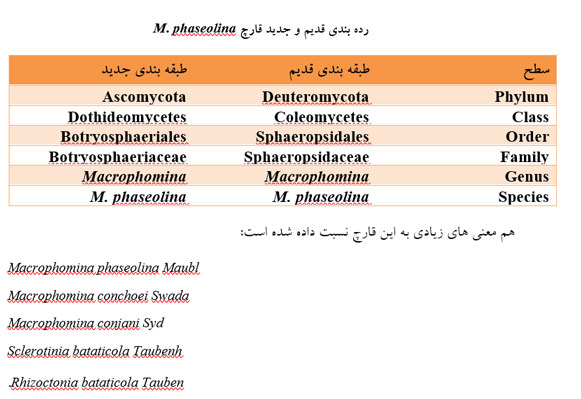
در ایران نیز عامل بیماری برای اولین بار در سال 1345 توسط شریف به نامSclerotium intestium Pet. Et Scharif تعیین هویت گردید سپس نام آن به قارچ M.phaseolina تغییر یافت (غفاریان و میناسیان, 1379). رده بندی قدیم و جدید قارچ عامل بیماری در جدول (2-1) به شرح ذیل می باشد (Wheeler, 1975) و (Crous et al., 2006).
ریخت شناسی قارچ M.Phaseolina
این قارچ فوق العاده تغییر پذیر و دارای جدایه هایی است که از نظر اسکلروت و وجود یا عدم وجود پیکنید متفاوت هستند. مرحله پیکنیدیومی در کنجد متدوال نیست اما در باقلا و لوبیا معمول است، بعضی از جدایه ها (بجز آن هایی که به سویا حمله می کنند) در محیط کشت پیکنید تولید می کنند. میکروسکلروت ها سیاه و گرد تا کشیده و نامنظم هستند. اندازه و شکل آن ها در یک جدایه و در سوبستراهای مختلف متفاوت هستند و به طور یکنواخت شبکه ای بوده از اجتماع سلول های ریسه ای که با یک ماده شبه ملانین بهم پیوسته اند، به وجود می آیند.
میکروسکلروتهای منفرد از 50 تا 200 سلول انفرادی که به وسیله یک منفذ مربوط به دیواره عرضی در هر سلول به هم پیوسته اند، تشکیل شده اند (شکل 2-4B) پیکنیدها در آغاز در بافت های میزبان فرو رفته اند، در زمان بلوغ نیمه سطحی هستند آن ها کم و بیش کروی، غشادار، تقریباً سیاه ذغالی، تیره تا خاکستری فام هستند که با گذشت زمان به رنگ سیاه در می آیند و معمولاً قطر آن ها 100 تا 200 میکرومتر است. دهانه کوچک و پخ پیکنید ممکن است نامشخص یا دارای یک منفذ مشخص باشد. خصوصیات کشت و ریخت شناسی ممکن است در بین جدایه ها و بر حسب سن کشت ها متفاوت باشد.
این قارچ روی محیط کشت سیب زمینی دکستروز آگار (PDA) به خوبی رشد می کند و بسته به میزان مواد غذایی سوبسترا، میکروسکلروت های فراوانی تولید می کند که قطر آن ها اغلب 50 تا 75 میکرومتر است. دمای مطلوب برای رشد در محیط کشت از 28 تا 35 درجه سانتی گراد متغیر است. ماکروفومینا در محیط کشت، پرگنه هایی تولید می کند که از سفید تا قهوه ای یا خاکستری متغیرند و با گذشت زمان، تیره تر می شوند. میسیلیوم هوایی، با رشد کاملاً یا تقریبا مجاور هم ممکن است تولید شود.
بعضی از جدایه ها، حلقه های رشدی متحدالمرکزی را ایجاد می کنند. انشعابات ریسه ای معمولاً با زاویه های راست نسبت به ریسه اولیه به وجود می آیند اما منشعب شدن با زاویه تند هم متدوال است. انشعابات ممکن است در نقطه اتصال دارای یک حالت فشردگی باشند که این موضوع باعث شد تا در ابتدا 1989 محققان این قارچ را به اشتباه در جنس Rhizoctomia طبقه بندی کنند (Sinclair and Backman1989).
زیست شناسی قارچ M. phaseolina
قارچ M.phaseolina یکی ازبیمارگرهای مهم خاکزاد و بذرزاد بوده که از طریق جوانه زدن اسکلروتها در داخل خاک و تماس با ریشه های کنجد باعث ایجاد بیماری میگردد (شکل2-4) (Abawi and Pastor, 1990Rayatpanah et al., 2006;). قارچ عامل بیماری میتواند گیاهان را از مرحله گیاهچه تا بلوغ آلوده نماید (Purkayastha et al., 2006). این قارچ انگل اختیاری بوده و در خاک به شکل اسکلروت باقی می ماند که منبع اولیه ی اینوکلوم است. اسکلروت ها با توجه به شرایط محیطی و حتی در غیاب گیاه میزبان می توانند 2 تا 15 سال در خاک زنده بمانند (Young et al., 1983, Baride et al. 2003; Cook etal., 1972; Short et al., 1980; Olaya and Abawi, 1996 ; Wrather et al., 1998).
در تعداد زیادی از بذرها ممکن است عامل بیماری زا در پوسته بذر وجود داشته باشد. بذرهای آلوده جوانه نمی زنند یا در صورت جوانه زدن به سرعت از بین می روند (شکل2-5). در مزارع کنجد عموماً در خاکهای که دارای نسبت بالای C/N، غلظت اکسیژن کمتر از 16 درصد و تراکم پایین بقایای گیاهی می باشند، به ندرت جوانه زنی میکرواسکلروتها برای مدت طولانی حفظ می شود(Gangopadhyay et al., 1982; Dhingra and Sinclair, 1978) . جوانه زنی اسکلروت ها، الگوی رشد هیف ها و شکل یا ساختمان آپرسوریوم در قارچ عامل پوسیدگی ذغالی phaseolina روی سطح ریشه به وسیله میکروسکوپ الکترونی بررسی شد. جوانه زنی آپرسوریوم در سطح ریشه در نوک دو هیف اصلی و شاخههای کناری در طول 3 روز بعد از تلقیح ظاهر می شوند (Vernon et al., 1975). این بیماری در دمای پایین آشکار نمی شود.
عامل بیماری شروع به رشد کرده و علائم در دمای 28 تا 35 درجه سانتی گراد بعد از مرحله گلدهی در کنجد ظاهر می شود(Young et al., 1983, Baride et al. 2003) . بیماری بیشتر در دوره های گرم و خشک سال، بویژه زمانی که دمای بالای 28 درجه سانتیگراد به مدت بیشتر از 2 الی 3 هفته دوام داشته باشد، توسعه می یابد. منبع اصلی آلودگی قارچ عامل بیماری در مورد بسیاری از میزبان ها، اسکلروتهای ریز و سیاه رنگ در خاک و بقایای محصول میزبان می باشد (Shorte et al., 1978).
اسکلروت ها می توانند در خاک های خشک یا بقایای باقی مانده از گیاه میزبان به مدت طولانی زنده بمانند ولی در خاک های مرطوب بیش از 7 تا 8 هفته و میسلیوم بیشتر از 7 روز نمی تواند زنده بماند. اسکلروت ها در طول فصل زمستان در اثر پوسیدگی بقایای ریشه و ساقه کنجد و شخم بهاره، در خاک مزارع پخش و منبع اولیه آلودگی به شمار میآید (.(Shorte et al., 1980 دمای بالا و پتانسیل پایین رطوبت خاک از عوامل مهم در ایجاد این بیماری هستند (Olaya et al., 1996; Shokes et al., 1997).
رطوبت پایین خاک به افزایش رشد عامل بیماری و باقی ماندن قارچ M.phaseolina در خاک کمک میکند. قارچ M.phaseolina وقتی که سطح مواد مغذی کم و دما بالاتر از 30 درجه سانتی گراد است، به خوبی با دیگر میکروارگانیسم های خاک رقابت می کند. رشد در خاک توسط مواد مغذی ذخیره شده در اسکلروت آغاز شده و تا زمانی که سطح مواد مغذی خاک برای قارچ های رقیب ناکافی شود ادامه می یابد. دمای بهینه رشد در آزمایشگاه از 30 تا 35 درجه سانتی گراد است(Momtaz and Vernon, 1975).
این قارچ به بذر، ریشه و ساقه گیاهان حمله می کند و باعث مرگ قبل از جوانه زنی و یا بعد از جوانه زدن میشود. در سیستم ریشه ای نیز این قارچ باعث انحلال همه بافت ها به جز آوندهای چوبی شده، و ریشه های آلوده دارای میسلیوم ها و سختینه های فراوان می گردند (Dhingra and Sinclair et al., 1974). این قارچ به شکل اسکلروت به صورت ساپروفیتروی ریشه های گیاهان مردهی میزبان دیده می شود. میزان آلودگی بسته به حساسیت رقم، شرایط آب و هوایی مناسب (دمای بالا و رطوبت پایین)، میزان آلودگی خاک و سیستم آبیاری متغیر است(Sinclair and Backman, 1989) .
جمعیت اسکلروتهای ماکروفومینا در خاک، رابطه مستقیم با شدت پوسیدگی ذغالی و رابطه معکوس با عملکرد محصول کنجد دارد (Anonymus., 2005). قارچphaseolin M. تعدادی از فیتوتوکسین ها به نام آسپرلین، فومنون، فومالکتون، اسید فازئولینیک و فازئولینون را تولید می کند ( (Dhar et al., 1982; Mahato et al., 1987; Bhattacharya et al., 1992 فازئولینون به ظاهر مهم ترین این ها است و القا کننده ی نشانه های بیماری در گیاهان مشابه به آنهایی که توسط عامل بیماری زا به وجود آمده اند (Bhattacharya et al., 1992). نقش مستقیم توکسین ها در بیماری زایی به وجود آمده توسط قارچ M.phseolina توسط چان مورد سؤال قرار گرفت (Chan., 1969) و نقش مهم آنزیم های محلول در دیواره سلولی در شروع بیماری و پیشرفت آن تأیید شده است. هرچند چندین گروه گزارش کرده اند که بیماری زایی قارچ M. phaseolina به توانایی آن در تولید توکسین ها مرتبط است(Rai and Singh, 1973) .
نقش توکسین های به وجود آمده توسط قارچ M.phaseolina در شروع بیماری هنوز گزارش نشده است. تعداد زیادی از قارچ های بیماری زا فیتوتوکسین ها را تولید می کنند ولی راهی که این توکسین ها با سیستم سلول مقابله می کنند فقط برای تعداد کمی از آن ها ثابت شده است (Ballio, 1991). زمانی که ارقام حساس به بیماری پوسیدگی ذغالی به طور مداوم در یک زمین کاشته شوند، جمعیت اسکلروت در خاک افزایش پیدا میکند.
جهت مشاهده نمونه های دیگر از مبانی نظری و پیشینه تحقیق مهندسی کشاورزی کلیک کنید.
نمونه ای از منابع لاتین
- Agrawal, S.C. and Nema .S. 1989. Legume Res.121: 45 – 46.
- Almeida, A. M. R., Abdelnoor, R. V., Arrabal Arias, C. A., Carvalho, V. P., Jacoud Filho, D. S and Marin, S. R. R. 2003. Genotypic diversity among Brazilian isolates of M. phaseolina revealed by RAPD. Fitopatologia Brasileira 28:279-285.
- Cook R. J and Papendick R. L. 1972. Influence of water potential of soils and plants on root diseases. Ann. Rev. Phytopathology. N10. P. 349 − 374.
- Dhar T. K., Siddiqui K.A. I and Ali E. 1982. Structure of phaseolinone, a novel phytotoxin from M. phaseolina. Appl. Environ. Microbiology. N23. P. 5459 – 5462.
- Dhingra O. D and Sinclair J. B. 1978. Variation among isolates of M. phaseolina 2000 − 2004.from different regions. Phytopathology. N76.
- Doupni B . 1993. Soybean production and diseases loss estimates for the centeral united states from 1989 to 1991. Plant Disease. 77: 1170 – 1171.
- Dhar, T. K., Siddiqui, A. I and Ali, E. 1982. Structure of phaseolinone, a novel phytotoxin from M. phaseolina. Appl. Environ. Microbiol. 23: 5459 – 5462.
- Dhingra, O. D and Sinclair, J. B. 1973. Variation among isolates of phaseolina from different regions. Phytopathology 76: 2000-2004.
- Doupnik, B. 1993. Soybean production and disease loss estimates for North Central United States from 1989 to 1991. Plant diseases. 77: 1170-1171.
- Gopal, k and Jagadeshwar, R. 1997. Reaction of soybean genotypes to charcoal rot ( phaseolina) J. Mycol. Pl. Pathol., vol. 27. No.1. 87-88.
- Jimenez – Diaz , R.M., Blance – Lopez , M.A ., and sackston, W.E .1983. Incidence and distribution of charcoal of slandflower casused by m.phaseolina in spain. Plant disease 67:1033-1036.
- Lindsay, W. L., and W. A. Norvell. 1978. Development of a DTPA test for zinc, iron, manganese, and copper. Soil Sci. Soc. Am. J. 42:421-428.
- …
- …
نقد و بررسیها
هنوز بررسیای ثبت نشده است.









نقد و بررسیها
هنوز بررسیای ثبت نشده است.